患者様向け
MSCとは
間葉系幹細胞(MSC)は、私たちの体内の骨髄、脂肪組織、臍帯(へその緒)などに存在する体性幹細胞(成体の組織にある幹細胞)の一種です。自己複製能力と、特定の細胞に分化する能力を持つことが大きな特徴です。
■ 主な特徴
- 多分化能: 中胚葉由来の細胞(骨、軟骨、脂肪、筋肉、血管内皮など)に分化できる能力を持っています。近年では、神経細胞や肝細胞など、他の組織の細胞へ分化できる可能性も示唆されています。
- 組織修復機能: 損傷した組織に移動し、細胞の増殖を促す因子や血管新生を促進する因子などを分泌することで、組織の修復と再生をサポートします。
- 免疫調整・抗炎症作用: 炎症を鎮めたり、過剰な免疫反応を抑制したりする免疫調整機能に優れています。これは、アレルギーや自己免疫疾患、移植後の拒絶反応などの治療において非常に重要視されています。
■ 再生医療での応用
- その優れた特性から、MSCは再生医療の分野で幅広く研究・応用が進められています。特に、心筋梗塞、脊髄損傷、変形性関節症、移植片対宿主病(GVHD)など、多くの疾患に対する細胞治療として期待されており、臨床応用が進められています。
GCリンフォテックのMSC
-
血清フリー培養による高い安全性
動物由来成分を含まない独自の培地を使用しているため、ウイルスや異種抗原混入のリスクを排除し、ヒトへの投与に適したクリーンな細胞の培養を実現しています。
-
生細胞製剤による高い活性維持
最終製剤は非凍結品であるため、細胞本来の接着能や代謝活性が維持され、即効性のある細胞治療を可能にします。
-
凍結細胞による安定供給
初回の脂肪採取で培養の途中で複数投与分の凍結細胞を作製します。以降は短期培養で迅速な提供が可能です。患者や医療機関のスケジュールに柔軟に対応します。
Q. 貴社のMSCは安全でしょうか?
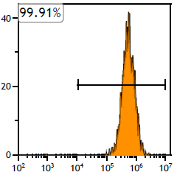
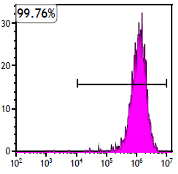
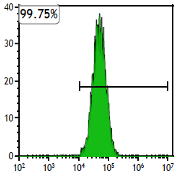
当社のMSCは、無菌試験・マイコプラズマ試験・エンドトキシン試験などの安全性評価に加えて、フローサイトメトリーによりCD73・CD90・CD105の発現(90%以上)を確認しています。これらの試験を通じ、臨床利用に求められる安全性と間葉系幹細胞の品質を確実に担保しています。
CD73の発現率
CD90の発現率
CD105の発現率
医療関係者向け
弊社MSCの特徴
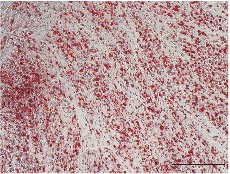
当社で培養したMSCを用いた分化誘導試験では、各分化条件下での形態変化および特異染色(アルカリフォスファターゼ染色、オイルレッドO染色、アルシアンブルー染色)を実施し、それぞれ骨形成、脂肪滴形成、軟骨基質産生が明瞭に観察されました。これらの結果は、当社のMSCが間葉系幹細胞としての本質的性質を保持したまま増殖していることを示しています。
Adipocyte
脂肪細胞
Osteoblast
骨芽細胞
Chondrocyte
軟骨細胞

■ 核型安定性の評価(G-banding核型分析)
当社MSCについて、G-banding法による核型分析を実施し、観察した全細胞において数的・構造的染色体異常は認められませんでした。
これにより、培養過程におけるゲノム安定性が維持されていること、ならびに腫瘍化リスクを増大させる染色体異常が生じていないことを確認しました。
■ 腫瘍原性の否定的評価(軟寒天培地コロニー形成試験)
腫瘍原性評価として、軟寒天培地(0.3% top agar / 1.0% base agar)を用いたコロニー形成試験を実施しました。
当社MSCは観察期間を通じてコロニー形成を示さず、足場非依存性増殖(anchorage-independent growth)は認められませんでした。
本結果は、がん細胞に特徴的な腫瘍様増殖能を有さないことを示すものであり、非腫瘍性が示されました。
■ マウス単回投与毒性試験による安全性評価
ヒト投与量を想定した安全性検証として、マウスに対しMSC 1.5×10⁸細胞および3.0×10⁸細胞相当量(ヒト60 kg換算)を単回投与し、14日間にわたり一般状態、体重推移、臓器重量、肉眼的・組織学的検査を含む包括的観察を実施しました。
その結果、いずれの投与群においても死亡例、臨床症状、毒性学的異常所見は認められませんでした。これにより、高用量条件下においても急性毒性が発現しないことが確認され、短期安全性が毒性学的に裏付けられています。
当社MSCは、分化能試験・表現型解析・安全性試験を通じて、間葉系幹細胞としての本質的特性と臨床利用に耐える品質を確認しています。
培養中のMSC

培養後のMSC
エビデンス①
膝関節炎に対する自己脂肪由来間葉系幹細胞の関節内注入の臨床的有効性と安全性
:第III相ランダム化二重盲検プラセボ対照試験
-
対象:ケルグレン・ローレンス(K-L)グレード3の膝関節炎患者
脂肪由来由来間葉系幹細胞群125例、対照群127例 - MSC投与量: 1×108個、1回注射
- プライマリーエンドポイント
-
- 以下の2項目の治療開始6ヶ月後の改善率
- ▪ 痛みに対する100-mm visual analog scale (VAS)
- ▪ 機能に対するWestern Ontario and McMaster Universities Osteoarthritis Index (WOMAC)
(安全性)重篤な治療関連の有害事象は観察されなかった

Kim et al. Am J Sports Med. 2023 Jul;51(9):2243-2253.
エビデンス②
「自己脂肪組織由来間葉系幹細胞の静脈内移植が慢性疼痛に及ぼす変化」
Mabuchi K, et al., 2025(Stem Cells and Development)
【要約】
自己脂肪由来間葉系幹細胞を静脈内投与し、慢性疼痛患者の痛みの変化を評価した臨床研究が報告されている。本研究では28 名の慢性疼痛患者に投与を行い、投与前後の痛み評価(Faces Pain Scale、Pain Disability Assessment Scale)を行った。その結果、投与4か月後の疼痛スコアが投与前に比べて有意に低下し、慢性疼痛の軽減が示唆された。また、In vitro の解析では、投与した MSC が ギャップジャンクションを介して血管内皮細胞/白血球へ小分子を移送する能力が示唆された。これらの結果は、自己脂肪由来間葉系幹細胞の静脈投与が疼痛改善に寄与する可能性を持つことを示している。
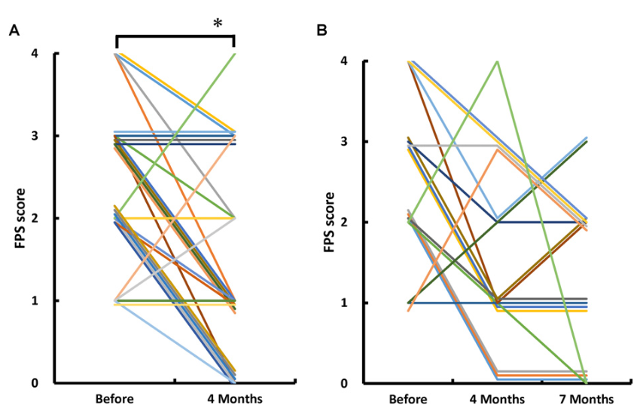
Fig.1|自己脂肪由来MSC静脈投与後の疼痛変化
本図は、自己脂肪由来幹細胞を静脈投与した前後における疼痛を評価するFaces Pain Scale(FPS)の変化を示している。28名の被験者それぞれについて、投与前と投与後(平均約4か月後)のFPSスコアが線で結ばれており、多くの症例でFPSの低下が認められる
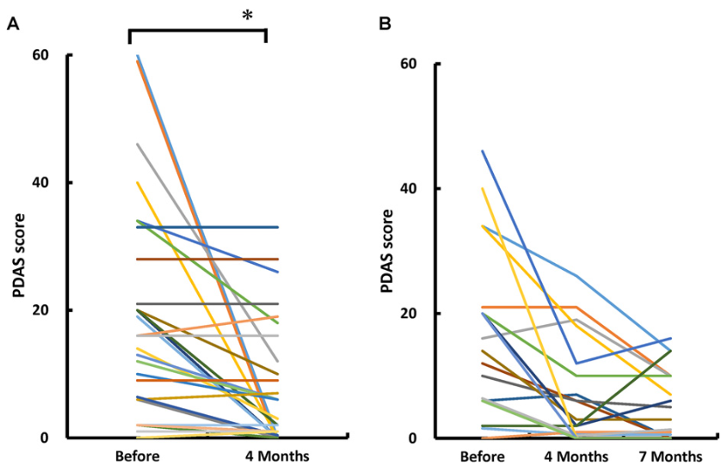
Fig.2|疼痛による生活障害の変化
本図は、慢性疼痛が日常生活に与える影響を評価する Pain Disability Assessment Scale(PDAS) の変化を示している。
間葉系幹細胞の投与前後におけるPDASスコアの変化が個々の患者ごとに示されており、疼痛による生活機能障害が投与後に改善していることが示されている。自己脂肪由来間葉系幹細胞の静脈投与は、疼痛に伴う生活障害の軽減にも寄与する可能性が示唆される。
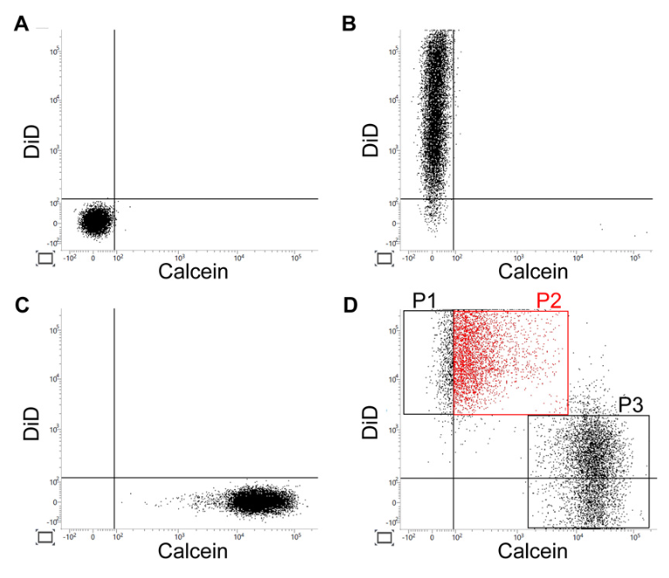
Fig.3|MSCのギャップジャンクションを介した小分子移送能
本図は、投与に用いられた自己脂肪由来間葉系幹細胞が持つギャップジャンクション機能を、フローサイトメトリーにより解析した結果を示している。非染色細胞(A)、膜標識色素DiDでラベルしたMSC(B)、およびカルセインを細胞内に取り込ませたMSC(C)を用い、共培養後にカルセインの細胞間移動を評価した。その結果、DiDでラベルされたMSCの約80%がカルセイン陽性となり(D)、MSC同士の間でギャップジャンクションを介した小分子の移送が起こることが示された。
この結果は、自己脂肪由来幹細胞が血管内皮細胞や白血球と直接的な細胞間相互作用を行う能力を有することを示唆している。
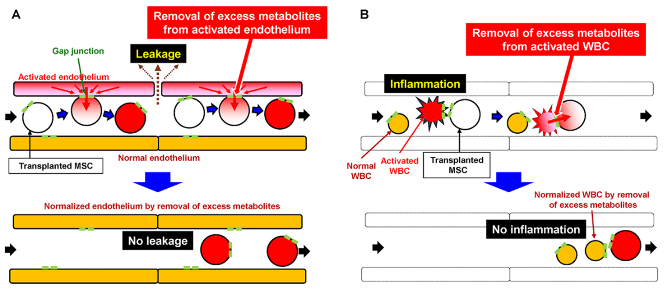
Fig.4|想定されるMSCによる慢性疼痛抑制の作用機序
本図は、本研究で提唱された自己脂肪由来MSCによる慢性疼痛抑制機構の仮説を模式的に示したものである。静脈内投与されたMSCは、過剰に活性化した血管内皮細胞(A)や白血球(B)とギャップジャンクションを介して直接接触し、細胞内に蓄積した代謝産物や小分子を除去すると考えられている。この過程により、炎症状態が正常化され、慢性炎症に起因する疼痛が抑制される可能性が示唆される。本図は、MSC療法を単なるサイトカイン分泌による作用ではなく、細胞間直接相互作用に基づく治療概念として位置づける重要なモデルを提示している。


