GCリンフォテックは、免疫細胞療法のパイオニアとして、白山通りクリニックを基幹医療機関とし、免疫細胞療法の普及に努めるとともに、免疫細胞治療を実施する医療機関に対し、技術・ノウハウ、資材、システム、技術者等を提供する「医療支援サービス」を展開してまいりました。
この度の再生医療関連法施行を機に、今まで培ってきた技術、実績をもとに、再生医療に取り組む医療機関や再生医療等製品の開発に取り組む研究機関の新しいパートナーとして、期待に応えられる組織・細胞等の加工受託企業へ転身いたします。
再生医療の産業化を取り巻く環境は追い風を受けています。
法整備を進めてきたわが国では、再生医療事業環境の活性化が過去に比べ著しく進んでいます。
2013年4月には再生医療の実用化を目指した再生医療推進基本法が議員立法として、通常国会で成立しました、
同年11月には、再生医療等の安全性の確保等に関する法律(再生医療安全確保法)、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(医薬品医療機器等法=改正薬事法)が成立しました。
再生医療関連法について
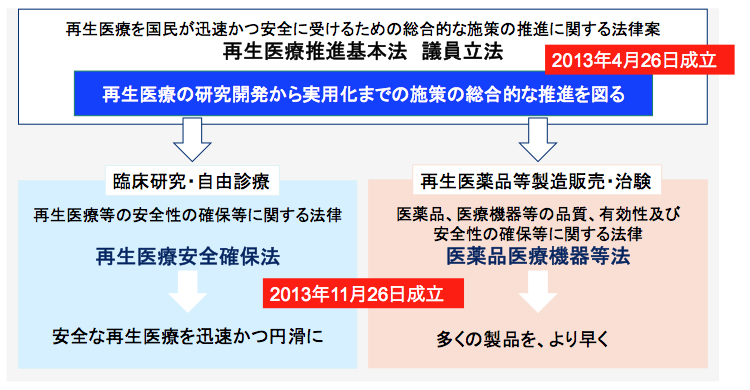
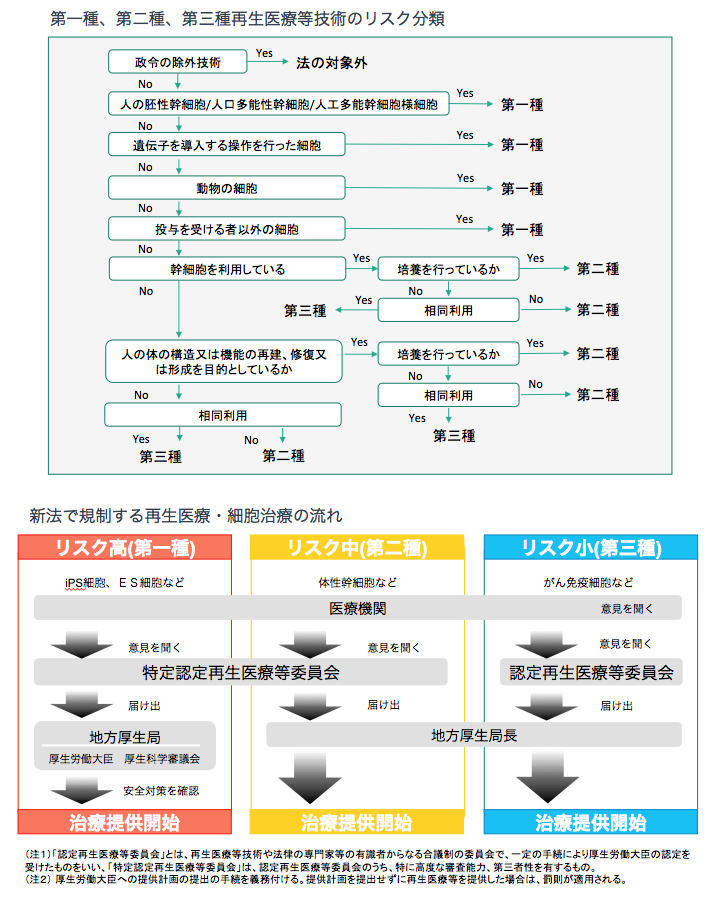
再生医療等安全性確保法においては、再生医療を3つのカテゴリーに分類して安全性の確保を図るリスク別安全性規制が導入された他、細胞加工業(特定細胞加工物の製造を外部委託できる仕組み)が新たに創設される事となりました。
医薬品医療機器等法においては、医薬品や医療機器とは別に「再生医療等製品」が新たに定義され、その特性を踏まえた制度(例:条件及び期限付承認制度、いわゆる早期承認制度)が導入されています。
これら 再生医療安全確保法、医薬品医療機器等法が本年11月25日に施行されました。
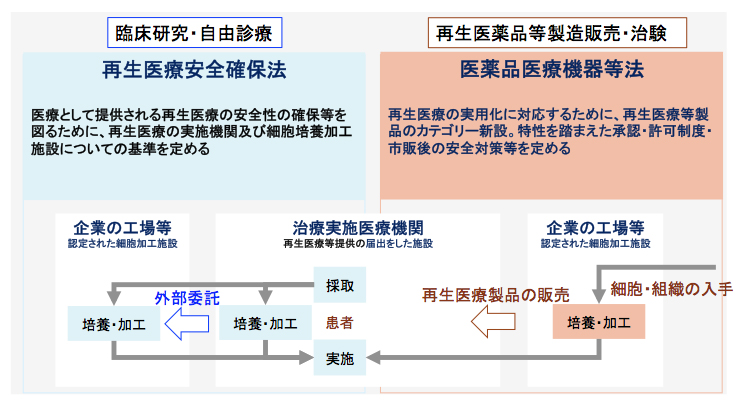
再生医療等の安全性の確保等に関する法律(平成25年法律第85号)
再生医療等の迅速かつ安全な提供等を図るため、再生医療等を提供しようとする者が講ずべき措置を明らかにするとともに、特定細胞加工物の製造の許可等の制度等が定められています。
〇 再生医療等の分類
〇 再生医療等の提供にかかわる手続き
〇 適正な提供のための処置
〇 特定細胞加工物の製造の許可
㌽ リスクに応じた再生医療の提供計画を厚生労働大臣もしくは、地方厚生局長に提出することが義務化されます。
㌽ 治療用の細胞加工について、地方厚生局長から許可を受けた企業等への外部委託が可能となります。
㌽ 届出・認可を得ずに治療や細胞加工を行った場合、本法律により罰則が科されます。
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律 (平成25年法律第84号)
医薬品、医療機器等の安全かつ迅速な提供の確保を図るため、添付文書の届出義務の創設、医療機器の登録認証機関による認証範囲の拡大、再生医療等製品の条件及び期限付承認制度の創設等が定められています。
〇 「医薬品」「医療機器」に加え「再生医療等製品」のカテゴリー新設
〇 再生医療等製品の特性を踏まえた安全対策の規制
〇 再生医療等製品の早期実用化に対した承認制度
㌽ 「再生医療等製品」を新たに定義するとともに、その特性を踏まえた安全対策等の規制が設けられます。
㌽ 均質でない再生医療等製品について、有効性が推定され、安全性が認められれば、早期に、
条件及び期限を付して製造販売承認を与えることを可能となります。
再生医療等製品の実用化に対応した承認制度
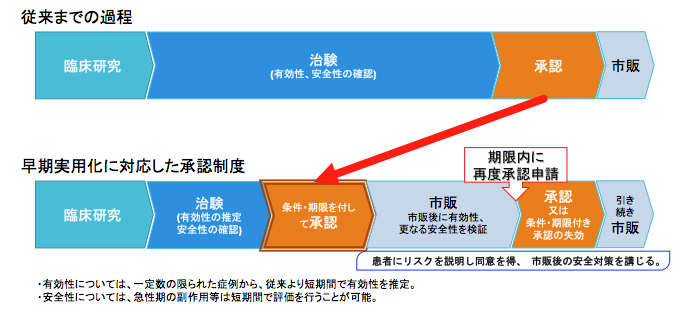
<再生医療等製品に従来の承認制度を適用する場合の問題点>
人の細胞を用いることから、個人差を反映して品質が不均一となるため、有効性を確認するためのデータの収集・評価に長時間を要します。
患者のアクセスをより早く、再生医療を少しでも早く患者さんが利用できるような環境の整備となっています。
再生医療等製品について、有効性が推定され、安全性が認められれば、一定の条件や期限を定めたうえで承認が与えられます。
